

【释疑解惑】面膜也可以是一种电子器件?
《力学园地》编辑部:
通过你们《力学园地》的文章,我们知道中科院力学所非线性力学国家重点实验室的苏业旺研究团队在可拉伸电子器件的研发方面取得不少进展。希望再介绍一些他们团队的工作。谢谢!
几个业余爱好者
2022年10月15日
李爽
数千年以来,“经皮给药”作为一种手段在医学治疗上已经做出了很大的贡献。相对来说,传统的直接给药方法有注射或口服等等,它们适用于全身性疾病和需要立即用药的急性疾病。但是对于某些局部性疾病,如果采用主动和靶向释放机制把药送达靶点(通俗地说,“靶点”就是病变部位),可以降低非靶点毒性并提高治疗的总体疗效。对于这种途径,经皮给药系统具有显著优势。所谓的经皮给药系统(Transdermal Drug Delivery Systems)是药物通过皮肤吸收的一种方法。具体而言,它是药物经由皮肤吸收进入人体血液循环并达到有效血药浓度、实现疾病治疗或预防的一种给药新途径。
目前,加速药物经皮导入的策略主要包括化学增强、离子导入、超声促渗、微针等等。其中的超声促渗是利用超声波的物理效应促使药物导入或穿过皮肤,像甘油、透明质酸(HA)、烟酰胺、纳米颗粒、蛋白质、DNA和病毒疫苗等多种药物都可以采用超声波来促进渗入效果。与化学增强和离子导入相比,超声促渗可以在更大的药物成分分子量范围内增加皮肤的渗透性,最大可达数万道尔顿(1道尔顿=碳12原子质量的1/12),而且不会对活细胞造成刺激或毒性,也不会引起严重的皮肤疼痛。微针不仅可以导入小分子还可以导入大分子,然而它需要刺入皮肤所以具有物理入侵性,增加了人们对安全性和无菌性的额外考虑。因此,超声促渗是一种有用的加速药物经皮导入的方式。
改善面部健康状况,对所有年龄段的人都具有意义。能否设计出一种可穿戴柔性电子器件将超声促渗技术应用于面部健康护理呢?这是一个很有吸引力的想法。所谓的“柔性电子器件”就是能够在弯折、扭曲、折叠和拉伸等情况下保持稳定电学性能的器件。和常规的硬质器件相比,柔性电子器件可方便地应用于可穿戴设备等多个领域,因而成为当下科学研究的热点之一。
近年来,研究者已经设计和制备了一系列的大变形柔性超声器件,这些器件在医疗健康领域有着巨大的应用潜力。其中的大多数用于贴合复杂表面,来监测一些人体信息或成像一些内部结构,比如中心动脉血压、血流速度、内部缺陷的三维图像,等等。此外,最近也有人们开始研究这类超声器件的主动治疗能力了,比如有研究者开发了一种柔性超声治疗贴,用于加速慢性伤口愈合。然而,目前尚未发现有研究者将这个技术应用于经皮给药或改善面部健康。对于后者,可拉伸电子面膜需要紧密地贴合在具有大面积、复杂表面的整个人脸上。这给研究带来了巨大的技术挑战。
近来,中科院力学所非线性力学国家重点实验室的苏业旺研究团队设计并制备了一种可拉伸电子面膜(SEFM),可以作为一种面部健康护理平台(参见图1)。作为一个器件级的演示装置,超声促渗的功能组件集成在平台上,以促进经皮给药。这个SEFM由可拉伸岛桥网状电路(含压电阵列)和人脸状封装两部分组成,其中特别设计的压电阵列的谐振频率为1 MHz。图1a展示了可拉伸电子面膜(stretchable electronic facial mask)的使用过程。图1b和1c给出了可拉伸电子面膜的内外视图,它的主要部件是岛桥网状电路(参见图1d-1f)。其中图1f给出了单个“岛”的结构细节,它是由铜/聚酰亚胺/铜(Cu/PI/Cu)复合体,连接片(solder),压电晶体(polarized PZT)等组合而成的。图1g则展示了:在超声波的空化效应作用下表皮(epidermis)细胞排列变得紊乱,从而其渗透性得到提高。
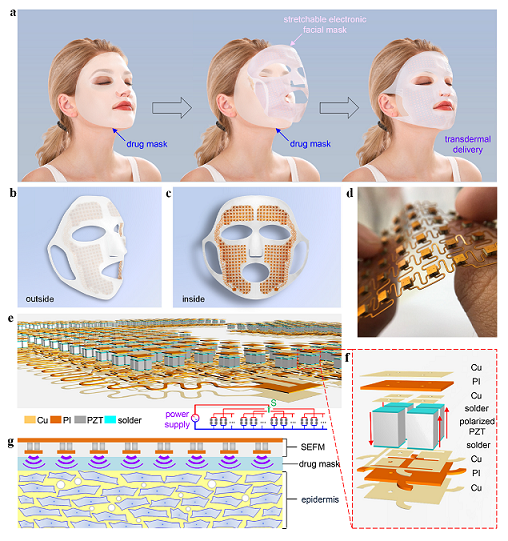
图1 SEFM的展示与机理示意:(a)SEFM的使用示意图;(b)SEFM的外视图;(c)SEFM的内视图;(d)可拉伸岛桥网状结构电路照片;(e)可拉伸岛桥网状结构电路示意图及其等效电路图;(f)单个岛的放大视图;(g)SEFM超声促渗的底层机理示意图
为了克服人脸的大面积复杂曲面带来的技术挑战,研究团队开发了一系列的关键设计和技术,其中包括:1)压电元件的单侧结构设计,以实现低弯曲刚度和高弯曲能力;2)由两个平面半脸部分沿非直线边界拼接的封装层设计,以实现平面岛桥网状电路的封装,并可与具有三维复杂曲面的人脸共形贴合;3)单面软压(SSSP)封装工艺,以进一步降低SEFM的刚度;4)有机-无机复合结构,以增强互连导线(“桥”)的延展性和鲁棒性;5)具有细长外形的四柱设计,以实现均匀的声强和较大的声场总功率。这些新技术还可望扩展到其他可拉伸电子器件的设计和制造。图2a展示了SEFM中岛桥网状电路的制备工艺,包括刻蚀(etching)、焊合(soldering)、切割(cutting)和翻转(turning over)等。这里一个关键的问题是如何将平面岛桥网状结构电路封装进入具有复杂不可展曲面的硅胶层里面。现有文献中提供的经验仅仅是预应变策略,即:在硅胶层拉伸成平面形状后,将电路粘合到硅胶层上,释放预应变后可形成具有复杂不可展曲面的人脸状的SEFM。但是,由于整个曲面非常复杂,且具有不规则的边缘,因此这个策略在电子面膜情况下是不切实际的。因为采用这种策略,封装出来的SEFM的几何形状非常不光滑和不美观,缘由在于硅胶层太薄,无法将岛桥网状结构电路限制在光滑表面内。研究团队通过设计由两个平面半脸连接而成的硅胶层克服了这一挑战。考虑到人脸的实际形状,用于封装的外部硅胶层如图2b所示进行设计:它包括两个平面部分,这两个平面部分沿两个半脸的非直边连接。相应的内封装是两片分离的具有半人脸状的硅胶层。将外部硅胶层折叠(folding)到平面状态(unfolding),封装操作可以分两次半面地进行。有限元分析(参见图2c)表明,在岛桥网状结构所在的区域,两种状态间的应变(strain)改变几乎为零,这大大降低了封装操作的难度。佩戴经验还证实,所设计的硅胶层能够共形贴合人脸的整个表面,而不会产生不舒服的张力。
为了保持封装后SEFM的低刚度,最佳策略是尽可能减少外部和内部硅胶层(silicone layers)之间的填充粘合剂(adhesive),尽管岛桥网状结构具有凹凸不平的形态。如图2d所示,研究团队利用用于封装的单面软压(SSSP)技术实现理想状态(图2e),即:内部透明硅胶层发生局部变形以适应岛桥网状结构的形态,而外部硅胶层保持几乎为平面的状态。如图2d所示,岛桥网状结构由内外硅胶层夹在中间,其间填充液体粘合剂(K-705,Kafuter,中国)。压力通过复合板施加到未完成封装的SEFM上,该复合板由钢板(steel layer)(杨氏模量为210 GPa,厚度为3 mm)和厚软弹性体(thick soft elastomer)(杨氏模量为60 kPa,厚度为12 mm)组成,并保持至液体粘合剂完全固化。图2f说明了单面软压过程中厚软弹性体和封装层的变形模式。内部透明硅胶层在厚软弹性体的压力作用下(pressing)局部被压进相邻岛之间的空间。然后将多余的粘合剂从SEFM边缘挤出并清理干净。完全凝固后,已封装SEFM的内表面保持凹凸形态。SEFM的封装操作可以分两次半面地进行。

图2 SEFM的设计与制备:(a)可拉伸岛桥网状电路的制作工艺;(b)用于封装的外硅胶层的折叠/展开两种状态;(c)折叠/展开两种状态之间应变改变的有限元分析;(d)用于封装的SSSP技术;(e)SEFM的实物图像;(f)单面软压过程中厚软弹性体和封装层的变形模式
研究团队还通过有限元方法和实验验证两条途径确认了SEFM的力学和热学性能(参见图3)。其中图3a、b和c分别直观地展示了SEFM的拉伸(stretching)、弯曲(bending)和扭转(twisting)的情况。图3d给出的是应变分布,其中对比了单侧设计(single-side-design)和双侧设计(double-side-design),给出了它们在有封装(encapsulation)情况下的应变分析,分别示出了正视(front view)图像和侧视(perspective view)图像。图3e给出了相对弯曲刚度(relative bending stiffness)随弯曲曲率(curvature)改变的变化情况,其中将人体皮肤的弯曲刚度设为1。类似地,相对拉伸刚度(relative tensile stiffness)随外加应变(applied strain)改变的变化曲线在图3f中给出,比较的参考值是人体皮肤的拉伸刚度。如图1f所示,目前的设计涉及铜/聚酰亚胺(Cu/PI)有机-无机复合结构,这有助于通过消除Cu的局部颈缩变形来提高其延展性。为了验证PI对Cu断裂的保护作用,研究人员对厚度为18 m/100 m/18 m、长度为40 mm、宽度为0.3 mm的直线形Cu/PI/Cu复合结构进行了单轴拉伸试验。图3g中的拉力(tensile force)和相对电阻变化(relative resistance change)随施加应变(按长度的%度量)的变化曲线表明:复合结构的破坏应变(>25%)远大于单层Cu(~1.5%),因此前者可以提供稳健的可拉伸性能。图3h示出岛桥网状电路中的“桥”(即蛇形互连导线)在外加单轴应变达到50%时的应变分布,这里整体蓝色就表明了应变值很小。此外,他们又将SEFM佩戴在人面上开展热学性能的测试,仅使其左侧区域工作,并利用红外热像仪进行测量。图3i给出环境温度为30 C、输入功率为6瓦时的温度分布。
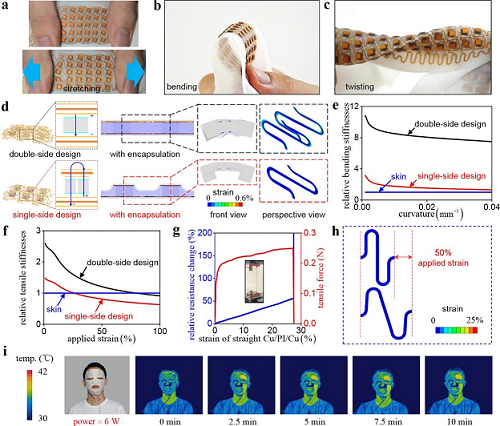
图3 SEFM的力学与热学性能:(a)拉伸;(b)弯曲;(c)扭转;(d)单侧与双侧两种设计下受到弯曲曲率为0.022/mm时的应变分布;(e)相对弯曲刚度随弯曲曲率的变化曲线;(f)相对拉伸刚度随施加应变的变化曲线;(g)Cu/PI/Cu复合结构的拉力与相对电阻变化随施加应变的变化曲线;(h)蛇形互连导线的单轴拉伸应变为50%时的应变分布;(i)SEFM佩戴在面部工作时的温度分布
类似地,SEFM的电学和超声性能在图4中给出,包括了研究团队完成的理论、有限元分析和实验的结果,主要涉及压电元件的设计和性能。首先,他们通过一维压电理论模型得到了压电柱的谐振频率f(单位为兆赫,MHz)与长度l(单位为毫米,mm)之间的关系,结果示于图4a中。其次,研究了不同横截面积压电柱的振动模式,压电柱的高度均为1.3 mm,但它们的截面积分别为0.1x0.1、1.0x1.0和10x10 mm2,图4b是它们的各部分的归一化位移(normalized displacement)云图。图4c是两柱设计(2-pillar design)和四柱(4-pillar design)设计的声强(intensity)分布的比较,其中声强的单位是每平方厘米瓦(W/cm2)。图4d则比较了上述两种设计的声场总功率(power),同样也是计算结果,其中功率的单位是瓦(W)。他们还给出了单个压电柱的阻抗Z-频率f曲线,同时对计算和实验结果进行了比较(参见图4e)。图4f则是实验给出的封装后SEFM的1/4区域的阻抗-频率曲线。此外,研究团队还做了一项演示实验(参见图4g),他们在一个压电柱的端面上放置水滴,从加电前后的视觉效果可以间接证明SEFM发射了超声波。最后,图4h示出了声强分布的实验测试(experiment)和有限元分析(FEA)的比较。
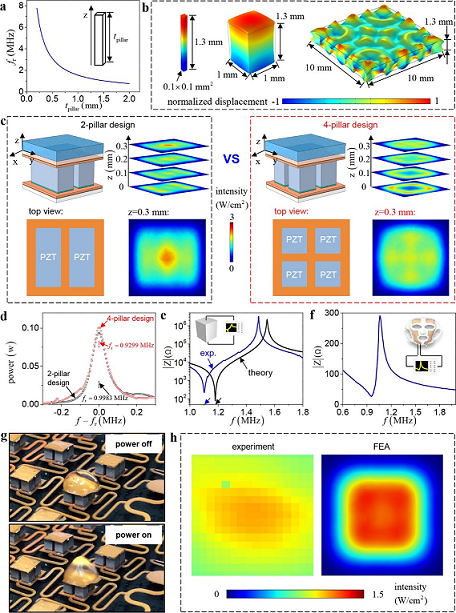
图4 压电元件的设计与性能:(a)压电柱的谐振频率与长度的关系;(b)不同横截面积压电柱振动模式的比较;(c)两柱和四柱设计的声强分布比较;(d)两柱和四柱设计之间声场总功率的比较;(e)单个压电柱的阻抗-频率曲线;(f)封装后SEFM的四分之一区域的阻抗频率曲线;(g)SEFM向水滴发射超声波的视觉效果;(h)FEA和实验的声强分布比较
最后研究团队进行了动物实验和人脸实验,证明了SEFM对于加速透明质酸(HA)导入皮肤的效果(参见图5)。他们选用了Sprague-Dawley大鼠作为动物实验对象,应用罗丹明标记测量不同皮肤深度下HA渗入量(参见图5a,b)。图5c给出了对照组(control)和超声组(ultrasonic)在不同皮肤深度(depth)下的荧光亮度(brightness)比较。图5d则是它们进行伪彩色处理后的共聚焦显微照片。在图5e中,又加入了加热组(heat)的荧光亮度数据进行比较。为了直观展示导入深度,在图5f中给出了上述三组实验的组织切片,其中的标尺为50 m。图5g给出人真皮成纤维细胞与SEFM共培养的活/死染色结果,可以看到:在1-5天的成型期内,成纤维细胞基本上是活的,死亡细胞的数量很少,证明了SEFM对成纤维细胞的生物相容性较好(参见图 5g)。为了展示皮肤完整性,在图5h中比较了对照组和超声组的组织切片,可以看到它们没有区别,因此证明超声组的皮肤没有被破坏。图5i是人脸实验的实景照片,正在利用SEFM将HA经皮导入面部。图5j是皮肤含水量增量(increment of skin moisture content)随时间(time)的变化,展示了对照组和超声组的比较。图5k则是超声组的皮肤含水量平均值的相对增量,这里以对照组为参照,表明采用SEFM后皮肤含水量可以增加20%左右。此外,需要指出的是,前人的研究已经证明可超声导入的其他药物也可以通过使用SEFM更有效地穿透皮肤,以达到不同的治疗效果。因此,苏业旺研究团队的这项工作不仅具有重要的学术意义,而且具有很好的产业化应用前景。
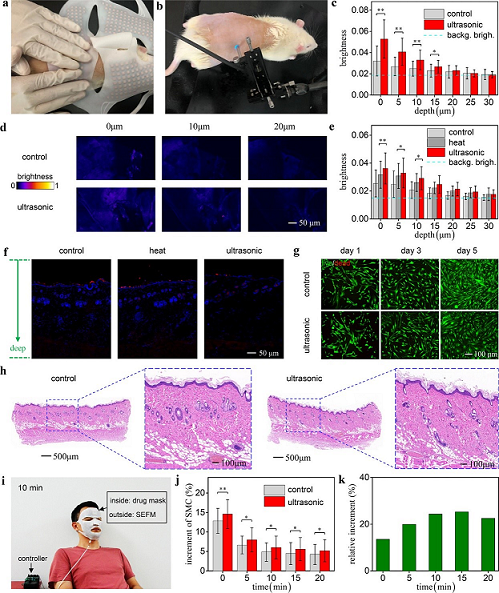
图5 HA经皮导入实验:(a)SEFM对实验鼠的HA经皮导入;(b)罗丹明标记HA的测量;(c)对照组和超声组在不同皮肤深度下的荧光亮度比较;(d)伪彩色处理后的共聚焦显微照片;(e)对照组、加热组和超声组在不同皮肤深度下的荧光亮度比较;(f)对照组、加热组和超声组的组织切片比较;(g)人真皮成纤维细胞与SEFM共培养的活/死染色结果;(h)对照组和超声组的组织切片比较;(i)利用SEFM在人体面部的HA经皮导入;(j)对照组和超声组皮肤含水量增量随时间变化的比较;(k)超声组和对照组之间皮肤含水量平均值的相对增量
附件下载: